Nat Comm | 陈雷组报道人源SOAT1(ACAT1)与竞争性抑制剂复合物的结构
胆固醇是动物体内一种重要的分子,它既是细胞膜的重要组成部分也是很多固醇类激素的前体,同时也参与众多信号通路。细胞内的游离胆固醇过多对细胞有害,所以哺乳动物细胞进化出一套精细的机制来调节游离胆固醇的含量。细胞内过多的游离胆固醇会在内质网被酰基化,从而以疏水的胆固醇酯的形式储存起来,这一过程由固醇酰基转移酶sterol O-acyltransferase(SOAT)所催化,该酶也被称为酰基辅酶A-胆固醇酰基转移酶acyl-coenzyme A: cholesterol acyltransferase(ACAT)。自从SOAT活力在20世纪50年代被发现以来,华人科学家在该领域做出了杰出的贡献。由达特茅斯盖塞尔医学院的Ta-Yuan Chang 和Catherine C. Y. Chang (Chang lab)领导的实验室在1993年率先克隆了哺乳动物soat1基因,随后杨洪远教授在其Ph.D.工作中克隆了酵母中的同源基因,李伯良教授、宋宝亮教授和许琛琦教授等国内科学家也对SOAT的调节及功能研究作出了重要贡献。这些工作提示SOAT是动脉粥样硬化、阿兹海默症和某些癌症等疾病的重要靶点。
在人体内,SAOT由两个基因编码:soat1和soat2。soat1广泛表达于各种组织,而soat2主要表达于肝脏和消化道。和很多代谢酶类似,SOAT的活力也受到底物胆固醇浓度的调节:当内质网内游离胆固醇浓度升高时,胆固醇会别构激活SOAT,从而催化胆固醇的酯化。因此SOAT上不仅具有底物胆固醇的结合位点,也具有起激活作用胆固醇的别构结合位点,这两个不同的胆固醇结合位点赋予了SOAT被胆固醇浓度反馈调节的特性。
近日,北京大学分子医学研究所陈雷课题组与北京大学化学院罗陀平课题组及美国达特茅斯盖塞尔医学院的Chang lab合作,在Nature Communications杂志上发表题目为 Structural insights into the inhibition mechanism of human sterol O-acyltransferase 1 by a competitive inhibitor 的文章,报道了人源SOAT1与竞争性抑制剂CI-976复合物的冷冻电镜结构。

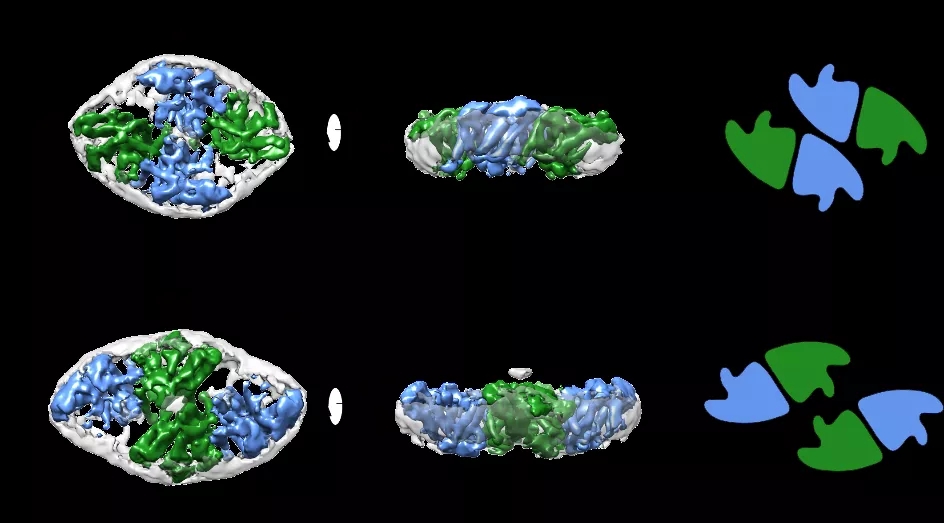
作者们首先解析了重组在nanodisc中人源SOAT1四聚体中等分辨率(7-8?)的冷冻电镜结构,该结构显示SOAT1四聚体是dimer of dimer,并且有两种不同的组装模式:卵圆形和菱形(图1)。这两种不同组装模式是由于SOAT1 二聚体不同的平行堆叠模式造成的。为了增加构象均一性从而提高分辨率,作者们将有功能的SOAT1二聚体组装进nanodisc,并解析了在小分子抑制剂CI-976结合状态下分辨率为3.5?的结构(图2)。作者们发现催化活性中心H460位于跨膜螺旋环绕着的空腔内(reaction chamber),竞争性抑制剂CI-976恰恰也结合在这个位置(图3),阻碍了底物的结合,这直观的解释了CI-976的工作机制。而CI-976的结合位点也被文中的生化实验所验证。
有意思的是这个空腔的胞质侧被一个“盖子”所掩盖,作者发现盖子上的一些氨基酸突变会严重影响SOAT1的活力,进而推测这些氨基酸可能与胞质侧底物酰基辅酶A的结合有关。为了进一步探求底物胆固醇、酰基辅酶A和激活胆固醇的结合位点,作者们将SOAT1的两个底物通过共价键连接成一个双底物类似物BiSAS。体外测活实验证明BiSAS是SOAT1的竞争型抑制剂。随后,作者们将SOAT1重组在含有胆固醇和磷脂的nanodisc中,并且加入BiSAS,进行冷冻电镜研究。遗憾的是,用该方法所获得结构与之前CI-976结合状态相比仅仅缺少了CI-976的密度,而其它位置的电子密度基本类似,这可能是nanodisc状态下的蛋白无法结合BiSAS和激活作用的胆固醇所导致的。作者们虽然观察到了一些非蛋白密度,其中包括形状非常象胆固醇的分子。但由于激活作用的胆固醇的亲和力很低,理论上无法与蛋白共纯化,以及分辨率有限,所以不能确认结合在这些位点的分子的具体成分。
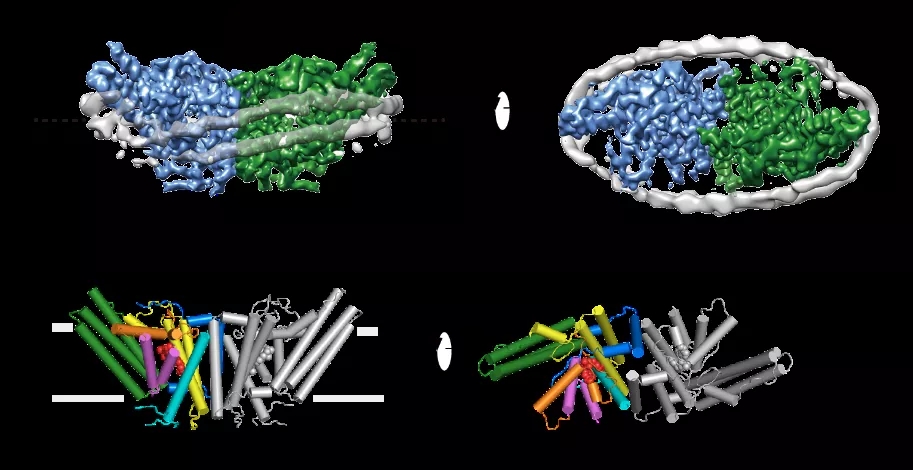
图2:人源SOAT1二聚体的冷冻电镜结构
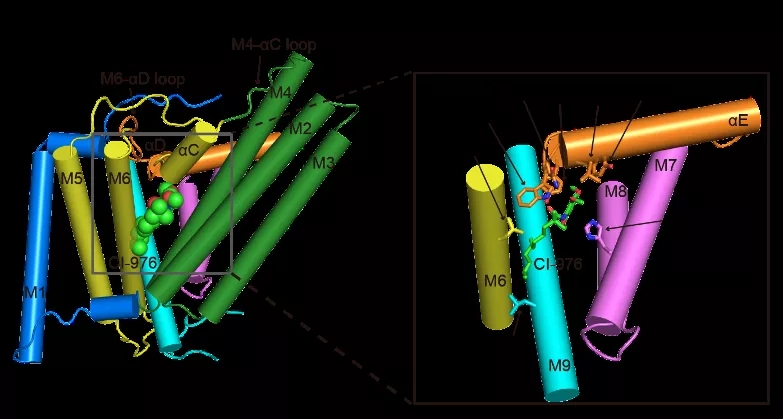
图3:竞争性抑制剂CI-976的结合位点
综上所述,本文展示了人源SOAT1蛋白dimer of dimer的架构、催化反应活性中心的位置以及竞争性抑制剂CI-976的结合位点。此项研究与2020年5月份发表于Nature的两篇SOAT1(ACAT1)的研究相得益彰(Nature | 周鸣/颜宁课题组合作揭示人源二酰甘油酰基转移酶DGAT1 三维结构及催化机制;Nature | 李晓淳团队解析人ACAT1结构),为进一步深入研究SOAT1催化与调控的机制奠定了基础。
据悉,本项研究主要由北京大学分子医学所博士后管成成完成,她得到了勃林格殷格翰公司博士后项目的资助。该研究还得到了陈雷课题组牛延革、康云路和吴惊香;罗陀平课题组陈思聪;Ta-Yuan Chang和Catherine C. Y. Chang及其课题组Koji Nishi的协助。该工作冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台上完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等工作人员的帮助。北京大学分子医学所代谢组平台权力和程昆仑提供了HPLC-MS技术支持。该项研究的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。厦门大学韩家淮教授提供了人源SOAT1的cDNA。
原文链接:https://www.nature.com/articles/s41467-020-16288-4附件下载:
