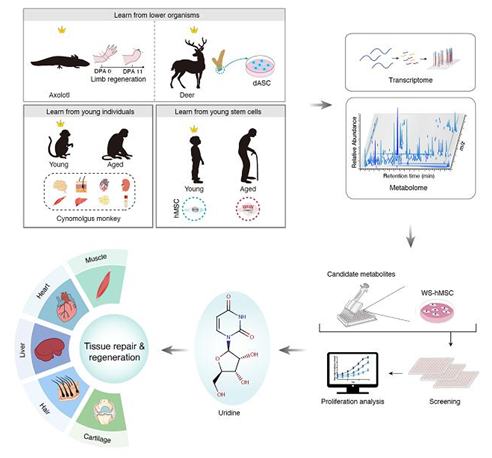
再生是机体修复受损、病变或衰老组织的重要过程。从低等动物到人类,不同物种具有不同程度的再生能力,并且这种能力随着物种的不断进化而逐步降低。例如,低等动物中的蝾螈能够实现断肢的完全再生,而包括人类在内的大多数哺乳动物仅具备有限的再生和损伤修复能力。在哺乳动物中,鹿角是唯一能够完全再生的器官。尽管高度进化的物种能在组织损伤时启动相应的再生修复程序,但这种再生修复的能力会随着年龄的增长而逐渐降低。众所周知,干细胞在组织再生和修复的过程中发挥着关键作用。例如,蝾螈可以通过形成芽基组织(一群去分化的具有干性的细胞)来完成肢体的再生。同样地,在每年的鹿角再生过程中,位于鹿角骨膜的鹿茸干细胞可以分化产生包含血管、软骨、骨、真皮和神经在内的完整鹿角器官。人类成体干细胞,如间充质干细胞,在多种组织和器官的再生修复过程中均起到关键作用,但是这些干细胞的数量和再生能力同样会随着机体年龄的增加而降低。
虽然人们已经发现机体再生能力随进化和衰老而逐步丧失的规律,但其中的分子机制尚不明确。内源性小分子代谢物在不同物种间相对保守;然而,迄今为止,人们对能够调节衰老和再生的小分子代谢物还知之甚少。通过向自然界存在的低等动物的再生过程学习、以及向具有较强再生能力的年轻组织和干细胞学习,理论上有望发现跨物种保守的、调节再生和衰老的关键代谢小分子,从而将为解码再生的代谢调控机制,发现促进再生、延缓衰老的关键代谢物提供新的线索和思路。
2022年2月1日,中国科学院动物研究所刘光慧研究组、曲静研究组和中国科学院北京基因组研究所张维绮研究组合作,于Cell Discovery杂志在线发表题为“Cross-species metabolomic analysis identifies uridine as a potent regeneration promoting factor”的研究论文。该研究深度解析了跨物种、跨年龄、跨组织的代谢分子特征,解码了与较高再生能力密切相关的代谢调节通路,鉴定了一系列能改够延缓人类干细胞衰老、促进多组织再生的关键通路和小分子代谢物,为衰老的科学评估、衰老相关疾病的防治以及再生医学的发展提供了潜在的分子标记物和干预策略。
该研究通过跨物种、跨年龄、跨组织地绘制多种细胞类型的代谢图谱,其中包括:蝾螈断肢再生的芽基、鹿茸干细胞、年轻和年老食蟹猴的多种组织(脑、心脏、肝脏、肌肉、肾脏、脂肪、皮肤、血液)以及年轻和衰老的间充质干细胞,系统揭示了一些跨物种保守的、再生相关的代谢通路。例如,再生能力强的生物样本更倾向于富集多胺代谢、尿嘧啶代谢和脂肪酸代谢通路。进一步结合人类干细胞衰老的研究平台,研究人员对潜在的促再生代谢物进行了细致的筛选,发现小分子代谢物尿苷(Uridine)可以明显提升衰老人间充质干细胞的自我更新能力。进一步研究表明,尿苷处理可以在5种小鼠的组织损伤模型(肌肉损伤模型、肝纤维化模型、毛发再生模型、心肌梗塞模型和关节炎模型)中助力损伤或病变组织的再生修复。在肌肉损伤模型中,尿苷有效提升了肌肉的再生修复能力、缓解了肌肉损伤引起的炎症反应,同时增强了小鼠的肢体抓力和系统运动能力;在肝脏纤维化模型中,尿苷缓解了四氯化碳诱导的肝纤维化,有效改善了肝功能的多个生理指标;在毛发再生模型中,尿苷处理可以刺激毛囊提前进入生长期,从而促进毛发的生长;在心肌梗塞模型中,尿苷能有效缓解急性炎症、提升损伤心脏的收缩能力;在关节炎模型中,尿苷可以促进关节软骨再生、提升小鼠的关节运动能力。以上结果表明,单一代谢物尿苷能够促进哺乳动物多器官组织的再生修复过程。与年轻个体具有较强的再生能力一致,年轻人血液中具有比老年人更高的尿苷含量。接下来,研究人员进一步探究了尿苷处理是否可以增强老年个体的生理机能。结果发现,两个月的口服尿苷处理可以增强老年小鼠(22月龄)的生理机能,表现为肢体抓力和运动能力的显著提升。这些发现从多个层面证实了尿苷具有抑制人类干细胞衰老、促进多组织再生修复、提高老年个体生理机能的潜在活性。
附图:通过跨物种和跨年龄的代谢组分析鉴定促进多组织修复、延缓衰老的关键代谢小分子。
该研究首次绘制了跨物种、跨年龄以及跨组织细胞的内源性代谢物的全景图谱,系统解析了强再生能力所伴随的分子代谢通路。更为重要的是,该研究发现尿苷是一种能延缓人类干细胞衰老、促进哺乳动物多组织再生修复的关键代谢物。这些发现为深入认识机体损伤或病理修复的机制奠定了理论基础,并为提升老年群体的健康、预防和治疗衰老相关疾病提供新的策略。
该研究的相关数据已同时上传至衰老多组学数据库Aging Atlas (AA, https://bigd.big.ac.cn/aging/index) 和再生多组学数据库Regeneration Roadmap (RR, https://ngdc.cncb.ac.cn/aging/index)。
该研究由中国科学院动物研究所、首都医科大学宣武医院、中国科学院北京基因组研究所(国家生物信息中心)、北京医院、北京大学第三医院等机构合作完成。中国科学院动物研究所刘光慧研究员、曲静研究员、中国科学院北京基因组研究所张维绮研究员为论文的共同通讯作者。中国科学院动物研究所博士研究生刘尊鹏、首都医科大学宣武医院助理研究员李维和副研究员耿令令、北京医院孙亮教授、中国科学院北京基因组所博士研究生王俏然以及北京大学第三医院于洋教授为论文的共同第一作者。该研究得到了北京大学韩敬东教授、中国科学院北京基因组研究所任捷研究员、中国科学院动物研究所宋默识研究员和黄仕强研究员、首都医科大学宣武医院王思研究员和长春科技学院李春义教授的指导与支持,同时获得了国家科技部、国家自然科学基金委、中国科学院及北京市等项目的资助。
原文链接:https://www.nature.com/articles/s41421-021-00361-3